iStock
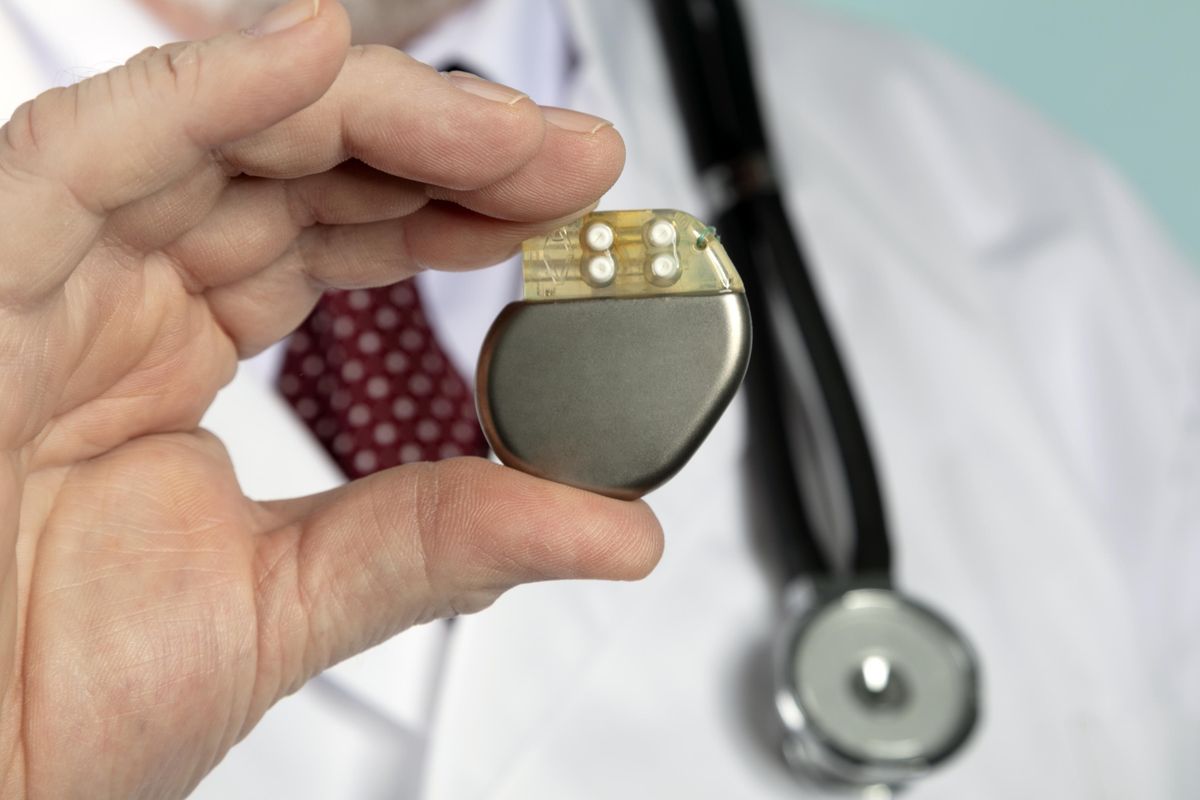
Dopo la stretta sulle certificazioni dei dispositivi medici, che colpiva migliaia di prodotti, l’Europa vuol dare più tempo alle ditte. Però, fino al rinvio dei termini, resteranno disagi.

Credo che uno degli errori in democrazia sia trasformare in tifoserie da stadio le diverse visioni che stanno a fondamento delle diverse gestioni della cosa pubblica. La propria squadra ha sempre ragione e l’altra sempre torto e, siccome non si è infallibili, i leader non sbagliano mai perché, ove sbagliano, o nessuno li critica oppure le critiche non fanno testo perché «vengono dall’altra parte»: e che volete che dica l’altra parte? Il risultato è che l’elettore - incapace di obiettare alla propria parte - smette di andare a votare. Se ne avvantaggia la sinistra, i cui elettori votano anche se la loro parte propone loro uno spaventapasseri. Tutto sto giro di parole ci serve perché ci tocca dire che il presidente della regione Friuli Venezia Giulia, Massimiliano Fedriga, ha sbagliato tutto sulla politica energetica in Regione.
Oltre 3.000 professionisti, club, aziende e istituzioni sportive hanno partecipato all’ottava edizione del Social Football Summit a Torino. Tra talk, workshop e premi internazionali, focus su tecnologia, intelligenza artificiale, infrastrutture e leadership femminile nello sport, con la Start Up Competition vinta da Wovlabs.
Ci parlano di femminicidi. In realtà ci assordano. Il signor Gino Cecchettin, padre di una figlia brutalmente assassinata, chiede corsi di prevenzione scolastica. Abbiamo una cinquantina di cosiddetti femminicidi l’anno su una popolazione di 60 milioni di abitanti. Ogni anno le donne assassinate sono poco più di cento, a fronte di 400 omicidi di maschi di cui non importa un accidente a nessuno. Abbiamo circa tre morti sul lavoro al giorno, al 98% maschi: anche di questi importa poco a tutti, a cominciare dal sindacalista Maurizio Landini, troppo impegnato in politica estera fantastica per occuparsi di loro. I suicidi sono circa 4.000 l’anno, e di questi 800 circa sono donne e 3.200 uomini. Il numero dei suicidi dei maschi è approssimato per difetto, perché molti maschi non dichiarano nulla e simulano l’incidente.