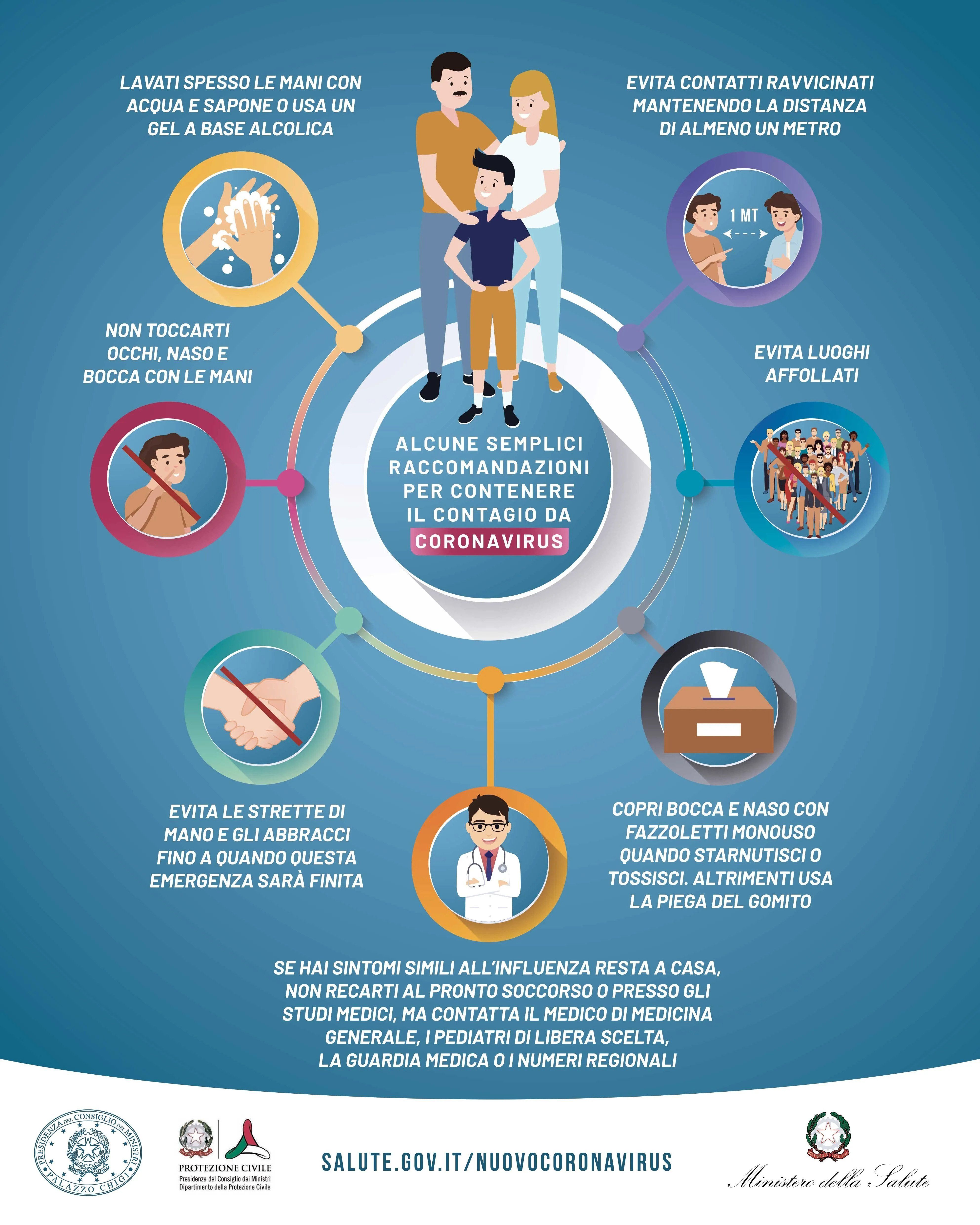
S’aggrappano alla Fda per imporre i vaccini. Ma rimangono i dubbi sui rischi per i minori
Dopo il «facciamo come Macron!» (sul green pass) è già partito il «Facciamo come gli americani!». Il via libera della Food and drug administration, che ha concesso l'approvazione completa al vaccino Pfizer, ha avuto un duplice effetto in Italia. Ha fatto cadere uno degli alibi cari ai no vax, ma ha anche ringalluzzito i fan dell'obbligo vaccinale. Quando c'è di mezzo il tifo, però, il rischio è quello di perdere lucidità. E questo vale per tutti. Facciamo quindi un po' di ordine partendo da quello che ha deciso l'Fda, dai caveat che ancora emergono, e dalle differenze tra Usa ed Europa.
L'autorità sanitaria americana, si legge nel comunicato diffuso lunedì, ha «approvato il vaccino Pfizer-Biontech per la prevenzione della malattia in individui di età pari o superiore a 16 anni». Continua, invece, a essere disponibile «con l'autorizzazione all'uso di emergenza (Eua) per gli individui di età compresa tra 12 e 15 anni e per la somministrazione di una terza dose in alcuni individui immunocompromessi». Va specificato che l'ok d'urgenza rilasciato l'11 dicembre 2020 allo Pfizer per gli over 16 dall'Fda era stato esteso ai 12-15enni solo il 10 maggio scorso, ma l'Fda scrive anche di aver condotto una «rigorosa valutazione dei dati di sorveglianza della sicurezza post autorizzazione relativi a miocardite e pericardite a seguito della somministrazione del vaccino», e i dati «dimostrano un aumento dei rischi, in particolare entro i sette giorni successivi alla seconda dose. Il rischio osservato è più elevato tra i maschi under 40 rispetto alle femmine e ai maschi più anziani». Ed è più alto «nei maschi di età compresa tra 12 e 17 anni». I dati disponibili dal follow up a breve termine suggeriscono che la maggior parte delle persone ha avuto una risoluzione dei sintomi. Tuttavia, viene aggiunto, «alcune persone hanno richiesto il supporto di terapia intensiva» e «non sono ancora disponibili informazioni sui potenziali esiti di salute a lungo termine». Eppure, la decisione dell'autorità sanitaria americana è arrivata a meno di quattro mesi dalla presentazione della richiesta, con tempi record per una procedura che di solito richiede almeno dieci mesi. Tanto da alimentare i dubbi su un pressing della politica per accelerare una serie di obblighi vaccinali nel Paese. «Per alcuni l'approvazione della Fda di un vaccino può ora infondere ulteriore fiducia», ha sottolineato il commissario ad interim della Fda, Janet Woodcock. Fiducia non accordata a Astrazeneca, considerando che la stessa autorità non ha ancora concesso l'autorizzazione per l'utilizzo del vaccino anglosvedese in America.
Questo succede comunque negli Stati Uniti. Ma qui da noi? Il 21 dicembre 2020 Pfizer-Biontech ha ricevuto dalle autorità europee un'autorizzazione all'immissione in commercio condizionata (Cma). Mentre l'autorizzazione di emergenza consente l'uso temporaneo di un medicinale non autorizzato in situazioni d'emergenza e non è un'autorizzazione alla messa in commercio del prodotto, la Cma dura un anno, può essere rinnovata e consente agli sviluppatori di presentare dati supplementari sul vaccino anche dopo l'autorizzazione all'immissione in commercio.
Questa autorizzazione potrebbe essere rinnovata il prossimo 21 dicembre, oppure potrebbe arrivare prima un via libera definitivo dell'Ema sulla scia dell'Fda. Secondo Peter Doshi, docente dell'Università del Maryland, le autorità dovrebbero però richiedere follow up a lungo termine e rendere i dati disponibili pubblicamente, prima di concedere la piena approvazione ai vaccini. «La diminuzione dell'efficacia può cambiare drasticamente il calcolo rischio-beneficio», ha scritto in un contributo sul British medical journal della British medical association, sottolineando i dubbi sulla durata dell'immunità.
In Italia ieri è arrivato il parere favorevole all'obbligatorietà dei vaccini da parte del Comitato nazionale di biosicurezza, biotecnologie e scienze della vita della presidenza del Consiglio, «con specifico riferimento a chi svolge funzioni pubbliche e attività che pongano il cittadino a stretto e contatto con altri soggetti e con l'ovvia esclusione delle situazioni di rischio di possibile patologia post vaccinale». Stando a quello che ha detto il sottosegretario alla Salute, Pierpaolo Sileri, una forma di obbligo verrà valutata solo per alcune fasce di età, quelle che «rischiano di più» come gli over 40, e comunque solo se «entro il 15 settembre» non avremo superato «la soglia dell'80% di popolazione che ha avviato il percorso di immunizzazione». Obiettivo raggiungibile, secondo il commissario Francesco Paolo Figliuolo, che ieri ha ricordato come la percentuale di coloro che hanno ricevuto almeno una dose supera già il 72,3% (oltre il 77%, se si sommano le monodosi e le persone colpite da infezioni pregresse). «L'obiettivo di vaccinare l'80% della popolazione over 12 anni sarà pienamente completato entro il 30 settembre», ha quindi assicurato il generale. Raffreddando l'entusiasmo degli yankees dell'obbligo vaccinale, almeno fino alla fine di settembre. Alla fine deciderà la politica, ma non potrà non tenere presente tutti i caveat delle autorità sanitarie. Soprattutto quelli sui minori.